|
3 電解質水溶液の化学平衡h 【電離平衡と水の電離】 電離平衡 これまでに,化学平衡の例としては気体反応を用いたが,化学平衡の状態は気体反応だけでなく溶液中の反応においても見られる。 酢酸CH3COOHのような弱酸が水に溶けると,一部が電離して,酢酸イオンCH3COO-と水素イオンH+が生成して,平衡状態になる。 〔 CH3COOH ⇄ CH3COO- + H+ 〕 このように電解質分子の一部が電離して,平衡状態になることを,電離平衡という。電離平衡の平衡定数を電離定数という。上の電離平衡の電離定数を表す式は下のようになる。 〔 Ka = [CH3COO―][H+]/[CH3COOH] 〕 酸の場合Ka,塩基の場合Kb (問)次の電離平衡の平衡定数を表す式を書け。 ① H2S ⇄ 2H+ + S2- ② Al(OH)3 ⇄ Al3+ + 3OH- ① Ka=[H+]2[S2-]/[H2S] ② Kb=[Al3+][OH-]3/[Al(OH)3] 水の電離と水のイオン積 水H2Oはわずかに電離して水素イオンH+と水酸化物イオンOH-を生じている。このとき生じているH+とOH-のモル濃度[H+]と[OH-]は等しく,25℃ではそれぞれ1.0×10-7mol/Lである。 電離〔 H2O ⇄ H+ + OH- 〕 K =〔 [H+][OH-]/[H2O] 〕 電離はごくわずかなので[H2O]の変化は無視できる(一定と見なせる)ので,[H2O]
を左辺へ移行してK[H2O]とする。K[H2O]は一定なのでKwとすると, Kw = 〔 [H+][OH-] 〕 (25℃では,=
(10-7)2 = 10-14〔(mol/L)2〕) このKwを〔 水のイオン積 〕といい,25℃では,〔 1.0×10-14 〕となる。 【pH(水素イオン指数)】 溶液の酸性の度合いを数値で表したもので,[H+]=10-aのとき〔 pH=a 〕とする。すなわち,〔 pH=-log10[H+] 〕である。 例題 次の各問いに答えよ。ただし,強酸・強塩基は完全に電離しているものとする。 (1) 0.10mol/Lの塩酸1.0mLを水でうすめて1000mLにした水溶液のpHを求めよ。 (2) 0.010mol/Lの塩酸100mLに36mgの水酸化ナトリウムを加えた水溶液のpHを求めよ。H=1.0,O=16,Na=23 (3) 0.010mol/Lの硫酸水溶液25mLに0.020mol/Lの水酸化カリウム水溶液75mLを加えた水溶液のpHを求めよ。水のイオン積Kwを1.0×10-14(mol/L)2とする。 (1) 4 (2) 3 (3) 12 【電離定数とpH】 弱酸である酢酸を水に溶かすと,酢酸分子の一部が電離し,電離平衡が成り立つ。さて,ここにC mol/Lの酢酸水溶液がある。この,電離度(電離する割合)をα(0≦α≦1)とすると, |
|
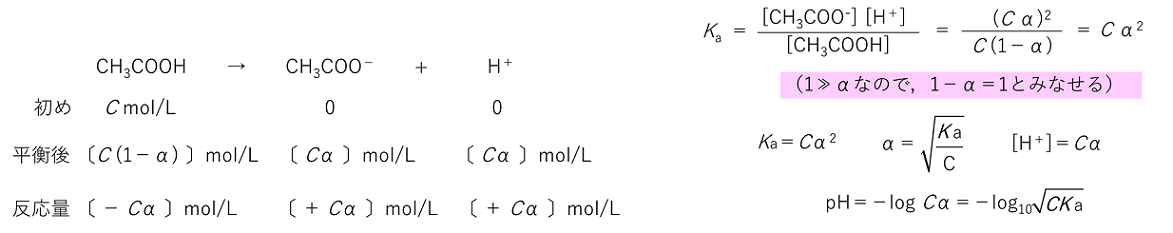 |
|
|
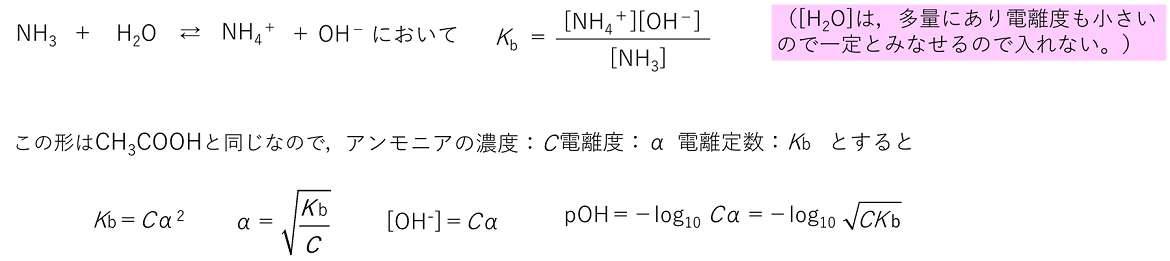
25℃における酢酸の電離定数はKa=1.8×10-5(mol/L )である。0.10mol/Lの酢酸水溶液の電離度,水素イオン濃度およびpHを求めよ。√1.8=1.3,log2=0.30,log3=0.48 α=1.3×10-2 [H+]=1.3×10-3〔mol/L〕 pH=-log10(√1.8×10-3)=-1/2log10(18×10-7)=2.87 弱塩基であるアンモニアNH3は,酢酸と同様に水に溶かすと一部が電離して平衡状態になる。 |
|
 |
|
|
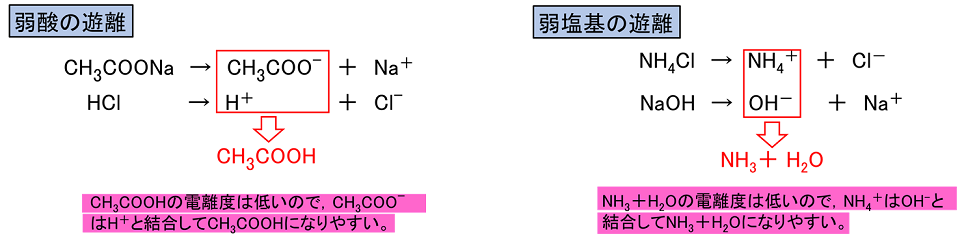
例題 25°Cにおけるアンモニア水の電離定数Kb=1.8×10-5(mol/L )である。0.020mol/Lのアンモニア水の電離度,水素イオン濃度およびpHを求めよ。ただし,水のイオン積Kw=1.0×10-14〔(mol/L)2〕,log2=0.30,log3=0.48を用いよ。 α=3.0×10-2 [H+]=1.7×10-11mol/L pH=10.8 【塩の加水分解と液性】 塩を水に溶かしたとき,塩のイオンと水が反応して,H+やOH-を生じる反応を,塩の加水分解という。塩は断りがない限り電離度を1とする。 正塩(H+もOH-も残ってない塩)の液性 強酸と強塩基からなる塩 ⇒〔 中 〕性 例)NaCl ・・・ HCl(強酸)とNaOH(強塩基)の中和でできる塩 NaCl → Na+ + Cl- (Na+,Cl-は水溶液中で安定に存在し,H2Oとは反応しない) 弱酸と強塩基からなる塩 ⇒ 〔 塩基 〕性 例)CH3COONa ・・・ CH3COOH(弱酸)とNaOH(強塩基)の中和でできる塩 CH3COONa → CH3COO- + Na+ 生じる酢酸イオンCH3COO-は,弱酸のイオンなので,H+と結合しCH3COOHになる傾向が強い。ここで,CH3COOーは水と反応し,CH3COOHになる。そのため,OH-が残り塩基性を示す。 〔 CH3COO- + H2O ⇄ CH3COOH + OH- 〕 CH3COONaで反応式を書くと,次のようになる。 〔 CH3COONa + H2O ⇄ CH3COOH + NaOH 〕 強酸と弱塩基からなる塩 ⇒〔 酸 〕性 例)NH4Cl ・・・ HCl(強酸)とNH3(弱塩基)の中和によってできる塩 NH4Cl → NH4+ + Cl- 生じるアンモニウムイオンNH4+は,弱塩基のイオンなので,OH-と結合しNH4OH(NH3 + H2O)になる傾向が強い。ここで,NH4+は水と反応し,NH4OHになる。そのため,H+が残り酸性を示す。 〔 NH4+ + H2O ⇄ NH4OH + H+ 〕 NH4Clで書くと,つぎのようになる。 〔 NH4Cl + H2O ⇄ NH4OH + HCl 〕 注意 1)弱酸と弱塩基からなる塩は判断が難しいので考える必要はない。 2)正塩の液性は塩をつくる酸,塩基の強弱をもとに判断できる。 酸性塩(酸のH+が残った塩)の場合 強酸と強塩基からできる塩 →〔 酸 〕性 例) 硫酸水素ナトリウムNaHSO4 NaHSO4 → Na+ + HSO4- 硫酸水素イオンHSO4-はさらに電離してH+を出せる 弱酸と強塩基からできる塩 →〔 塩基 〕性 例) 炭酸水素ナトリウムNaHCO3 NaHCO3 → Na+ + HCO3- 炭酸水素イオンHCO3-は弱酸のイオンで,H2Oと反応するのでOH-が残る。 HCO3- + H2O → H2CO3 + OH- 強酸と弱塩基からできる塩→〔 酸 〕性 ☆ 強酸,強塩基の組み合わせ以外は,正塩と同様に強い方が出る。 例題 次の塩の水溶液の液性を答えよ。 ① Na2CO3 ② K2SO4 ③ NH4NO3 ④ KHCO3 ① 塩基性 ② 中性 ③ 酸性 ④ 塩基性 H2SO4やH3PO4などの二価や三価の酸からは,Hが残ったHSO4-やH2PO4-といった陰イオンも考えられ,これらの陰イオンと塩基から生じる陽イオンからなる塩にはNaHSO4やNaH2PO4といったHを含んだものがある。このようにHが残っている塩を酸性塩という。同様にOHが残っている塩もあり,これらを塩基性塩という。また,NaClなどHやOHが残っていない塩を正塩という。 (注意)この呼び方は「酸性を示す」,「塩基性を示す」,「中性を示す」という意味ではない。 【弱酸・弱塩基の遊離】 弱酸の塩である酢酸ナトリウムCH3COONaの水溶液に強酸である塩酸HClを加えると,弱酸である酢酸CH3COOHができる。これを〔 弱酸の遊離 〕という。また,弱塩基の塩である塩化アンモニウムNH4Clの水溶液に強塩基である水酸化ナトリウムNaOHの水溶液を加えると,弱塩基であるアンモニアNH3ができる。これを〔 弱塩基の遊離 〕という。 |
|
 |
|
|
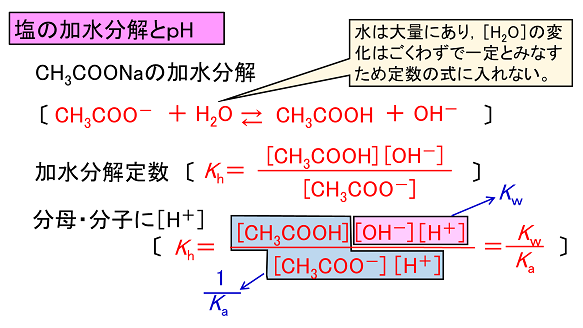
【塩の加水分解とpH】 酢酸ナトリウムCH3COONaは酢酸(弱酸)と水酸化ナトリウムNaOH (強塩基)の中和によってできる塩である。この酢酸ナトリウムは水溶液にすると水溶液中の水と反応(加水分解)し,塩基性を示す。では酢酸ナトリウム水溶液のpHを求めてみよう。 CH3COONaは完全に電離して酢酸イオンCH3COO-とナトリウムイオンNa+に電離する。ここで生じるCH3COO-は「塩の加水分解」で説明したように水と反応して下のような平衡状態になる。 |
|
 |
|
|
この関係を用いると,Kw,Ka,Khから[OH-]が求められ,これから[H+]を計算すればpH が求められる。 例題 5.0×10-2mol/Lの酢酸ナトリウム水溶液のpH を求めよ。ただし酢酸の電離定数Ka=2.0×10-5[mol/L],水のイオン積Kw=1.0×10-14[(mol/L)2],また,log2=0.30, log3=0.48とする。 酢酸ナトリウムの濃度をC mol/Lとすると,酢酸ナトリウムは完全に電離するので生じる酢酸イオンはC mol/Lになる。この酢酸イオンが水と反応するので,生じる水酸化物イオンをxmol/Lとすると,平衡後の各物質の濃度は次のようになる。 |
|
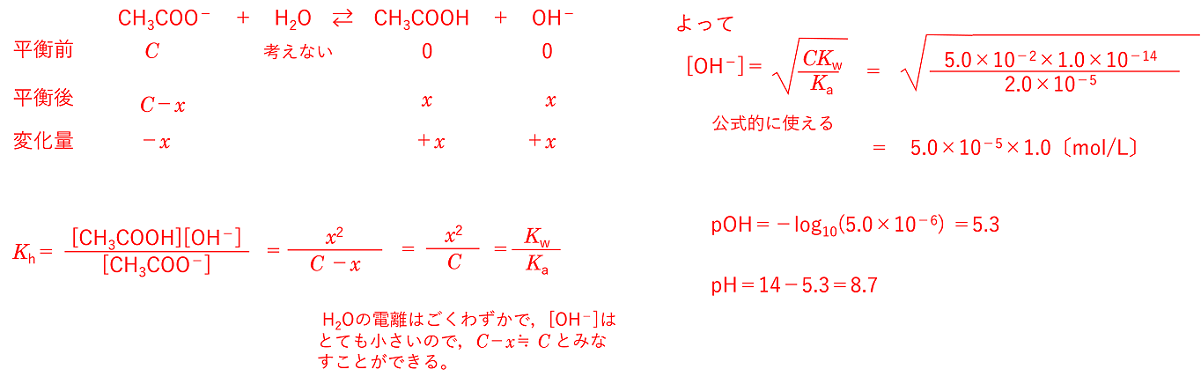 |
|
|
【緩衝溶液とpH】 純水に少量の酸や塩基を加えると,その水溶液のpHは大きく変化するが,弱酸とその塩または弱塩基とその塩の混合水溶液に酸や塩基が少量加わってもpHはほとんど変化しない。この働きを緩衝作用といい,緩衝作用をもった溶液を緩衝溶液という。 例1) 弱酸とその塩の混合水溶液(酢酸と酢酸ナトリウム) 酢酸は弱酸なので平衡状態で電離し,酢酸ナトリウムは完全に電離している(塩の電離度は1)。この溶液に酸(H+)が加わると,多量に存在する酢酸イオンCH3COO-と反応して酢酸CH3COOHに変化するためH+が加わってもpHは変化しない。この溶液に塩基(OH-)が加わると,溶液中のH+と反応してH2Oに変化するが,平衡移動によりH+は再び生じるので,OH-が加わってもpHは変化しない(左下)。 |
|
 |
 |
|
例2) 弱塩基とその塩の混合水溶液(アンモニアと塩化アンモニウム) この溶液に塩基(OH-)が加わると,多量に存在するアンモニウムイオンNH4+と反応してアンモニアNH3と水H2O(NH4+とOH-でNH4OHとなるが,実際にはNH3とH2Oに分解している)に変化するためOH-が加わってもpHは変化しない。この溶液に酸(H+)が加わると,溶液中の水酸化物イオンOH-と反応してH2Oに変化するが,平衡移動により再びOH-が生成するので,H+が加わってもpHは変化しない(右上)。 例題 0.050 mol/L酢酸水溶液10mLと0.10 mol/L酢酸ナトリウム水溶液5.0mLからなる緩衝液のpHを求めよ。ただし,酢酸の電離定数Ka=1.8×10-5mol/L log2=0.30,log3=0.48とする。 混合後の水溶液は,15mLになるので,酢酸は10mLから15mLになった(1.5倍に薄まった)ので,酢酸のモル濃度は,0.050/1.5〔mol/L〕,同様に酢酸ナトリウムは5.0mLから15mLになった(3.0倍に薄まった)ので,酢酸ナトリウムのモル濃度は,0.10/3.0〔mol/L〕。 また,酢酸水溶液のモル濃度をC mol/L,酢酸ナトリウム水溶液の濃度をC ′mol/L,平衡後のH+をxmol/Lとすると,電離後の各物質のモル濃度は次のようになる。 |
|
 |
|
|
よって,x=(0.050/1.5)×(3.0/0.10)×1.8×10-5 = 1.8×10-5〔mol/L〕 pH = -log10(1.8×10-5)=4.74 【滴定曲線】 中和滴定の際,加えた酸や塩基の体積と混合液のpHとの関係を示した図を滴定曲線という。左下の図は0.10 mol/Lの酸を0.10mol/Lの水酸化ナトリウム水溶液で滴定したときの滴定曲線である。 |
|
 |
|
|
HCl(強酸)の場合は少しずつ中和されpHはゆるやかに上昇していく。中和点の前後では,加えた1滴の差でpHがほぼ3→11へと急激に変化する。 CH3COOH場合は弱酸なのでpHはあまり小さくならない。そのため中和点以前のグラフはHClに比べ上を通る。また,CH3COOHの場合,滴定のごく初期のpH変化はHClよりも大きい。これは,酢酸が弱酸で,少量のNaOHの滴下でpHが上がってしまうからである。しかし,すぐにpHの変化が小さい状態になる。これは滴定によって酢酸ナトリウムが生じ,未反応の酢酸と共に緩衝溶液となっているためである。また,CH3COOHの場合,中和点では塩基性を示す。これは生じた酢酸ナトリウムが加水分解して塩基性を示すからである。このような理由で,弱酸-強塩基での滴定曲線は一般に右上図のような形になる。 【共通イオンの影響(難溶性塩の溶解度積)】 これまでに扱ってきた塩は電離度1のものを扱ってきたが,塩の中には水に溶けにくいものも存在する。代表的な難溶性塩として塩化銀AgClがある。難溶性の塩は弱酸や弱塩基のように極一部が電離し,平衡状態になっている。 この平衡定数Kは次のようになる。 〔 K = [Ag+][Cl-]/[AgCl(固)] 〕 ここで,Ag+とCl-は極一部なので,[AgCl(固)]は一定とみなせるので,[AgCl(固)]を定数に含め,Kspとすると このKspをその塩の溶解度積といい,一定温度で物質固有の値となる。この値は,溶液中にそのイオンが存在できる最大濃度の積ということになり,Kspが小さい塩ほど沈殿しやすく,次のようにして沈殿の生成の有無が判断できる。Ag+とCl-を例に取ると,[Ag+][Cl-]>Kspの場合,AgClの沈殿が生成する。[Ag+][Cl-]<Kspの場合は沈殿の生成はない。 例題 1.0L中に0.10
molのCl-と0.010 molのCrO42-を含む水溶液に,Ag+を少しずつ加えていくと初めに沈殿するのはAgClとAg2CrO4のどちらか。ただし,AgClのKspは2.8×10-10[mol/L]2,Ag2CrO4のKspは2.0×10-12[mol/L]3とする。 より少量のAg+でKspを超える方が先に沈殿する。AgClはAgCl?Ag++Cl-なので,[Ag+][Cl-]=Kspとなるときの[Ag+]をxmol/Lとすると,x×0.10=2.8×10-10より,x=2.8×10-9〔mol/L〕。一方,Ag2CrO4はAg2CrO4?2Ag++CrO42-なので,[Ag+]2[CrO42-]=Kspとなるときの[Ag+]をymol/Lとすると,y2×0.010=2.0×10-12より,y=√2×10-5〔mol/L〕。よって,x<yより,AgClの方が先に沈殿する。 |
|
 |
|